Mientras tanto, ayudando en la tarea :3
Música
lunes, 9 de junio de 2014
martes, 11 de febrero de 2014
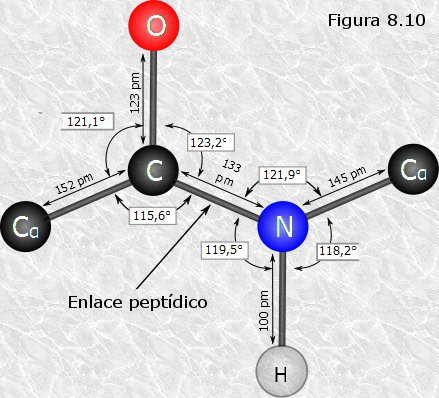
EL ENLACE PEPTÍDICO
La unión de dos o más aminoácidos (AA) mediante enlaces amida origina los péptidos. En los péptidos y en las proteínas, estos enlaces amida reciben el nombre de enlaces peptídicos y son el resultado de la reacción del grupo carboxilo de un AA con el grupo amino de otro, con eliminación de una molécula de agua (Figura de abajo).
El enlace peptídico (-CO-NH-) se representa normalmente como un enlace sencillo. Sin embargo, posee una serie de características que lo aproximan más a un doble enlace.Como el nitrógeno es menos electronegativo que el oxígeno, el enlace C-O tiene un 60% de carácter de doble enlace mientras que el enlace C-N tiene un 40%. Por tanto, los enlaces C-O y N-C del enlace peptídico tienen características intermedias entre el enlace sencillo y el enlace doble. De hecho, las distancias interatómicas medidas en los enlaces C-O y C-N son intermedias entre las del enlace sencillo y el doble enlace. Esta disposición atómica está estabilizada por resonancia (Primer figura), de forma que los seis átomos implicados en la formación del enlace peptídico están contenidos en el mismo plano (Segunda figura).
|
| Normalmente, la configuración trans está favorecida. Sólo en el caso de que el segundo AA del enlace peptídico sea la prolina puede resultar favorecida la configuración cis. |
 Los péptidos sólo podrán cambiar de conformación mediante el giro en torno a los enlaces sencillos en los que intervienen los Catetraédricos (Figura de la derecha). Los péptidos sólo podrán cambiar de conformación mediante el giro en torno a los enlaces sencillos en los que intervienen los Catetraédricos (Figura de la derecha).En cada AA, el Ca puede establecer dos ángulos de torsión con los planos de los dos enlaces peptídicos contiguos: los llamados f (phi)y y (psi) (Figura de la derecha):
En la estructura de un péptido o de una proteína, cada AA presenta un valor de f y otro de y determinados. Es el tamaño físico de los átomos o grupos de átomos presentes en las cadenas laterales el que determina los posibles valores que pueden adoptar los ángulos phi (f) y psi (y).  Cuando se representan los valores de phi (f) y psi (y) de cada AA se obtiene la gráfica de Ramachandran (Figura de la izquierda), en la que se distinguen tres regiones con valores "permitidos" de los ángulos de torsión ya que no dan lugar a impedimentos estéricos en la estructura. Cuando se representan los valores de phi (f) y psi (y) de cada AA se obtiene la gráfica de Ramachandran (Figura de la izquierda), en la que se distinguen tres regiones con valores "permitidos" de los ángulos de torsión ya que no dan lugar a impedimentos estéricos en la estructura.Estas regiones corresponden a los dos tipos de elementos estructurales mayoritarios presentes en las proteínas: la estructurab y la a-hélice. Todo crédito a su respectivo dueño. Yo lo único que hago es compartir sus conocimientos. |
CULTIVO CONTINUO (SISTEMAS ABIERTOS). QUIMIOSTATO
El cultivo continuo es un cultivo balanceado mantenido por tiempo
indefinido por un sistema abierto de flujo que se compone de:
-una cámara de cultivo de volumen constante, a la que llega un suministro de nutrientes, y de la que se eliminan o separan los productos tóxicos de desecho (por un dispositivo de rebosadero).
Una vez que el sistema alcanza el equilibrio, el número de células y la concentración de nutrientes en la cámara permanecen constantes, y entonces se dice que el sistema está en estado estacionario, con las células creciendo exponencial mente.
Los parámetros a tener en cuenta son:
-flujo (f), medido en ml/h
-volumen de la cámara de cultivo (v, en ml)
-densidad celular en la cámara (x)
-factor de dilución D = f/v (en h-1).
Existe una pérdida de células por el rebosadero: -dx/dt = x·D
El crecimiento bruto es dx/dt = x·µ
Por lo tanto, el crecimiento neto es dx/dt = x·µ - x·D = x·(µ - D)
Si logramos que el coeficiente de crecimiento (µ) se haga igual al factor de dilución (D), entonces dx/dt = 0, y por lo tanto la concentración de células se hace constante (x= x). El cultivo se encuentra entonces en estado dinámico de equilibrio. Las pérdidas de células por drenaje se compensan con las ganancias por crecimiento.
aspectos fisiológicos (por ejemplo, catabolismo del sustrato limitante);
selección de mutantes
estudios ecológicos.
Turbidostato
Permite cultivos continuos con un coeficiente m cercano al m máx, trabajando a valores altos de D. Ello lo logra ajustando los valores de densidad celular de modo que ningún factor nutricional se haga limitante.
Se dice que es un sistema de control interno porque es la misma concentración de bacterias la que regula el flujo de entrada y de salida (por medio de un mecanismo electrónico basado en la medición y control de la densidad óptica del cultivo).
Aplicaciones: se emplea bastante en el estudio de los factores que incrementan o disminuyen la tasa de crecimiento.
Quimiostato
Para introducirnos al funcionamiento del quimiostato, partamos de la observación de lo que pasaría en el turbidostato si desconectamos el fotómetro y ajustamos la bomba 1 para que vierta medio fresco al cultivo a una tasa (flujo) menor que el que mantiene la mcercana a la m máx:
las bacterias tenderían a crecer a mayor velocidad que su dilución debida a adición de medio fresco; por lo tanto, en un principio aumentaría la concentración de bacterias.
Pero este incremento no podría continuar indefinidamente. Pero el crecimiento tampoco se detendría. De hecho, tras un cierto tiempo, el cultivo alcanzaría un nuevo estado estacionario de equilibrio, en el que la tasa de crecimiento se hace proporcional a la tasa de adición de medio fresco. En este caso, el cultivo crece exponencialmente, pero a tasas m <m máx. Sigue creciendo exponencialmente porque la tasa de dilución del cultivo es una función exponencial del tiempo.
La m submáxima viene determinada en el quimiostato por la tasa de dilución (D). La cinética sigue siendo exponencial, ya que en el nuevo estado estacionario de equilibrio latasa de crecimiento compensa a la tasa de dilución, que como sabemos, es una función exponencial.
Ventajas del quimiostato en comparación con el turbidostato:
En un quimiostato, los microorganismos pueden cultivarse a una amplia variedad de tasas de crecimiento exponencial, mientras que, como vimos, en el turbidostato se cultivan en un rango estrecho de valores de m cercanos al m máx.
El quimiostato permite crecimientos balanceados restringidos debido a que existe un nutriente o sustrato presente en una concentración suficientemente baja como para limitar la densidad de población.
SR es la concentración de nutriente en el reservorio, y determina el valor de S, que es la concentración de nutriente limitante en el recipiente de cultivo.
La tasa de adición de ese sustrato determina la tasa de crecimiento.
Así pues, el quimiostato también permite elegir la densidad de células a la que se quiere trabajar.
-una cámara de cultivo de volumen constante, a la que llega un suministro de nutrientes, y de la que se eliminan o separan los productos tóxicos de desecho (por un dispositivo de rebosadero).
Una vez que el sistema alcanza el equilibrio, el número de células y la concentración de nutrientes en la cámara permanecen constantes, y entonces se dice que el sistema está en estado estacionario, con las células creciendo exponencial mente.
Los parámetros a tener en cuenta son:
-flujo (f), medido en ml/h
-volumen de la cámara de cultivo (v, en ml)
-densidad celular en la cámara (x)
-factor de dilución D = f/v (en h-1).
Existe una pérdida de células por el rebosadero: -dx/dt = x·D
El crecimiento bruto es dx/dt = x·µ
Por lo tanto, el crecimiento neto es dx/dt = x·µ - x·D = x·(µ - D)
Si logramos que el coeficiente de crecimiento (µ) se haga igual al factor de dilución (D), entonces dx/dt = 0, y por lo tanto la concentración de células se hace constante (x= x). El cultivo se encuentra entonces en estado dinámico de equilibrio. Las pérdidas de células por drenaje se compensan con las ganancias por crecimiento.
Una de las maneras de lograr un cultivo continuo es mediante el llamado quimiostato: en el quimiostato podemos controlar de modo independiente la densidad de la población celular y la velocidad de crecimiento del cultivo. La densidad celular en el equilibrio se controla ajustando el factor de dilución (D), mientras que la velocidad de crecimiento se controla variando la concentración del nutriente limitante en la cámara reservorio (SR).
En un quimiostato, los microorganismos pueden cultivarse a una amplia variedad de tasas de crecimiento exponencial,
El quimiostato permite crecimientos balanceados restringidos debido a que existe un nutriente o sustrato presente en una concentración suficientemente baja como para limitar la densidad de población.
Así pues, el quimiostato también permite elegir la densidad de células a la que se quiere trabajar.
Algunos comentarios sobre el gráfico:
La densidad del cultivo es muy similar en un amplio margen de tasas de dilución (D). Este margen es el más adecuado para hacer estudios en el quimiostato. En cambio, el valor de tiempo de generación (g) varía
ampliamente. O sea, el quimiostato puede obtener tasas de crecimiento muy diferentes, sin que se afecte la densidad celular.Sin embargo, a valores extremos de dilución, se puede ver que el equilibrio se rompe:
A altas tasas de dilución la concentración microbiana cambia rápidamente, y en un margen estrecho el cultivo puede drenarse totalmente (DC: dilución crítica). Es decir, el cultivo se “lava” porque su velocidad de recimiento es inferior a la tasa de dilución.
A muy bajas diluciones (DM) el quimiostato no funciona si el nutriente limitante es la fuente de energía. Ello se debe a que en esas condiciones, la fuente de energía sólo se usa para reacciones de mantenimiento de la
integridad celular, pero no queda para el crecimiento. A este valor lo llamamos energía de mantenimiento. Los procesos relacionados con esta energía de mantenimiento son el potencial de membrana, el transporte de solutos y la renovación de proteínas.
Aplicaciones del cultivo continuo en quimiostato:
Aportan una fuente continua de células en fase exponencial, lo que se aplica a procesos industriales de fermentación (producción de bebidas alcohólicas, de antibióticos, de aminoácidos, etc).
En el quimiostato, el crecimiento a bajas concentraciones de sustrato permite estudiar:
aspectos fisiológicos (por ejemplo, catabolismo del sustrato limitante);
selección de mutantes
estudios ecológicos.
Turbidostato
Permite cultivos continuos con un coeficiente m cercano al m máx, trabajando a valores altos de D. Ello lo logra ajustando los valores de densidad celular de modo que ningún factor nutricional se haga limitante.
Se dice que es un sistema de control interno porque es la misma concentración de bacterias la que regula el flujo de entrada y de salida (por medio de un mecanismo electrónico basado en la medición y control de la densidad óptica del cultivo).
Para el mecanismo de su funcionamiento, por favor atender la explicación en clase y consultar el esquema suministrado en la Fig.
Inconvenientes:- es difícil de manejar y ajustar;
- si las bacterias tienen tendencia a adherirse a superficies (paredes internas del aparato), los resultados de medida de la D.O. quedan falseados (infravalorados).
Aplicaciones: se emplea bastante en el estudio de los factores que incrementan o disminuyen la tasa de crecimiento.
Quimiostato
Para introducirnos al funcionamiento del quimiostato, partamos de la observación de lo que pasaría en el turbidostato si desconectamos el fotómetro y ajustamos la bomba 1 para que vierta medio fresco al cultivo a una tasa (flujo) menor que el que mantiene la mcercana a la m máx:
las bacterias tenderían a crecer a mayor velocidad que su dilución debida a adición de medio fresco; por lo tanto, en un principio aumentaría la concentración de bacterias.
Pero este incremento no podría continuar indefinidamente. Pero el crecimiento tampoco se detendría. De hecho, tras un cierto tiempo, el cultivo alcanzaría un nuevo estado estacionario de equilibrio, en el que la tasa de crecimiento se hace proporcional a la tasa de adición de medio fresco. En este caso, el cultivo crece exponencialmente, pero a tasas m <m máx. Sigue creciendo exponencialmente porque la tasa de dilución del cultivo es una función exponencial del tiempo.
La m submáxima viene determinada en el quimiostato por la tasa de dilución (D). La cinética sigue siendo exponencial, ya que en el nuevo estado estacionario de equilibrio latasa de crecimiento compensa a la tasa de dilución, que como sabemos, es una función exponencial.
Ventajas del quimiostato en comparación con el turbidostato:
En un quimiostato, los microorganismos pueden cultivarse a una amplia variedad de tasas de crecimiento exponencial, mientras que, como vimos, en el turbidostato se cultivan en un rango estrecho de valores de m cercanos al m máx.
El quimiostato permite crecimientos balanceados restringidos debido a que existe un nutriente o sustrato presente en una concentración suficientemente baja como para limitar la densidad de población.
SR es la concentración de nutriente en el reservorio, y determina el valor de S, que es la concentración de nutriente limitante en el recipiente de cultivo.
La tasa de adición de ese sustrato determina la tasa de crecimiento.
Así pues, el quimiostato también permite elegir la densidad de células a la que se quiere trabajar.
sábado, 8 de febrero de 2014
Metodologia ABP
Antecedentes (metodologia ABP):
1910
Flexner presenta su:
Reporte sobre la educación medica
En el cual se propone que se enseñe de la siguiente forma:
/La enseñanza de los procesos biológicos, dentro de las asignaturas bascas *teoría*
/La enseñanza de las alteraciones de los procesos biológicos, en las asignaturas clínicas (practica)
60'
Universidad Mc Master, Canadá.
Universidad Case Western Reserve, USA
Como propósito:
es evitar la confrontación entre la forma de aprender durante los estudios y la forma de trabajar en la vida real.
Metacognicion:
Razonamiento de alto nivel que implica un control activo sobre los procesos cognitivos implicados en el aprendizaje.
Accion de pensar sobre el propio pensamiento.
Metodología abp-utilidad:
Combinar y sintetizar la información presentada en la situación en una o mas hipótesis explicativas; estas hipótesis
no son diagnósticas sino que tratan de dar explicar la información presentada en la situación o problema.
Identificar necesidades de aprendizaje relacionadas al conocimiento, a las habilidades y a las actitudes.
A partir de lo aprendido, identificar los principios y conceptos para poder aplicarlos a otras situaciones o problemas.
M.A. estrategias y habilidades a desarrollar (ABP):
Habilidades a desarrollar:
Comunicar los resultados de una investigación en forma oral, gráfica y por escrito.
Razonar critica y creativa mente.
Tomar decisiones razonadas y analizar en situaciones originales.
Identificar, encontrar y analizar la información requerida para una tarea particular.
Comunicar ideas y conceptos a otras personas.
Lograr la auto confianza necesaria para usar sus habilidades de comunicación y pensamiento en un grupo de personas.
Sustento teórico:
El entender de la realidad surge del medio ambiente.
El conflicto cognitivo estimula el aprendizaje.
Comparación y relación:
Características esenciales de un problema:
Comprometer interés.
Fomentar toma de decisiones , juicios e información lógica y fundamentada.
Cooperación de todos los integrantes.
Ligar aprendizaje previo.
Incorporar objetivos del curso.
Evaluación:
Se fundamenta el constructivismo, la evaluación debe estar
pendiente de todo proceso de construcción del conocimiento y no solo del final.
Debe cubrir:
Los resultados del aprendizaje de los contenidos programados.
El conocimiento que el alumno aporta al proceso de razonamiento del equipo.
Las interacciones personales del alumno con sus compañeros.
Las actitudes frente al proceso de aprendizaje.
La toma de decisiones como actitud de conducción en el aprendizaje.
Hipótesis
Explicaciones fundamentadas con base en la
explicación proporcionada por el caso a través de las pistas y problemas planteados según el nivel de conocimientos.
Colágeno :3
Para qué sirve:
Contribuye a disminuir el dolor de las articulaciones originado por desgaste, la pérdida de densidad de los huesos y las arrugas de la piel.
Es un componente principal de todos los tejidos como los huesos, músculos, tendones, ligamentos; su total compatibilidad con las células cutáneas y su asimilación por todo tipo de pieles, incluso por las más sensibles.
Por qué se produce:
Principalmente para. La síntesis normal del colágeno depende de la hidroxilacion correcta de la lisina y la prolina en el RE, llevada a cabo por la lisil y prolil hidroxilasa, enzimas que necesitan el acido ascórbico como coenzima para funcionar correctamente. La deficiencia de vitamina “C” impide la correcta hidroxilación y, por lo tanto, la formación en triple hélice de las fibras de colágeno que mantienen la estructura de los tejidos.
Función:
Las fibras de colágeno forman estructuras que resisten las fuerzas de tracción. Su diámetro en los diferentes tejidos es muy variable y su organización también; en la piel de los mamíferos están organizadas como cestos de mimbre, lo que permite la oposición a las tracciones ejercidas desde múltiples direcciones. En los tendones lo están en haces paralelos que se alinean a lo largo del eje principal de tracción. En el tejido óseo adulto y en la córnea se disponen en láminas delgadas y superpuestas, paralelas entre sí, mientras las fibras forman ángulo recto con las de las capas adyacentes.
Las células interactúan con la matriz extracelular tanto mecánica como químicamente, lo que produce notables efectos sobre la arquitectura tisular. Así, distintas fuerzas actúan sobre las fibrillas de colágeno que se han secretado, ejerciendo tracciones y desplazamientos sobre ellas, lo que provoca su compactación y su estiramiento.
Como se produce:
El colágeno es una proteína, y como todas ellas, su síntesis comienza en el núcleo de las células. La mayor parte de ellas son fabricados por un tipo especial de células, llamadas “fibroblastos”, que se encuentran en la matriz extracelular o tejido conectivo. El proceso se inicia en su interior, copiando el código del DNA que está en el núcleo celular, en un templado. Posteriormente este templado, sale del núcleo y migrando por el citoplasma celular, llega a los sitios de lectura y síntesis de la proteína. Ellos son los llamados “ribosomas”. Se trata de estructuras citoplasmáticas, encargadas de la síntesis de proteínas.
Composición química:
Se caracterizan por su predominio en su constitución de los aminoácidos: Glicina, Prolina, Hidroxiprolina y Hidroxilisina
Cuál es su estructura:
Triple hélice formada por Glicina, Prolina e Hidroxiprolina.
El colágeno posee una estructura secundaria tridimensional consistente en una "cadena α" (no confundir con α hélice), es una hélice levógira con alrededor de 3 residuos aa por vuelta. En cuanto a la estructura terciaria, tres cadenas α súper enrolladas forman una triple hélice dextrógira.
Características:
Las fibras colágenas son flexibles, pero ofrecen gran resistencia a la tracción. El punto de rotura de las fibras colágenas de los tendones humanos se alcanza con una fuerza de varios cientos de kilogramos por centímetro cuadrado. A esta tensión solamente se han alargado un pequeño porcentaje de su longitud original.
Cuando el colágeno se desnaturaliza por ebullición y se deja enfriar, manteniéndolo en una solución acuosa, se convierte en una sustancia muy conocida, lagelatina.
Base molecular:
La unidad esencial del colágeno está constituida por tres cadenas de polipéptidos que aparecen entrelazadas formando una triple hélice, constituyendo una unidad macromolecular denominada tropocolágeno.
La base molecular del colágeno está constituida por cadenas de polipéptidos y cada uno de éstos es un polímero de aminoácidos. Son cadenas constituidas por aminoácidos, que son unidades moleculares pequeñas. Cada uno de estos aminoácidos se caracterizan por tener por lo menos dos funciones distintas: un amino y una ácida en la misma unidad molecular. Los polipéptidos no son más que cadenas de estos aminoácidos que se encuentran en los organismos biológicos en números limitados.
Tipos de colágeno:
Colágeno tipo I: Se encuentra abundantemente en la dermis, el hueso, el tendón, la dentina y la córnea. Se
presenta en fibrillas estriadas de 20 a 100 nm de diámetro, agrupándose para formar fibras colágenas mayores.
Sus subunidades mayores están constituidas por cadenas alfa de dos tipos, que difieren ligeramente en su
composición de aminoácidos y en su secuencia. A uno de los cuales se designa como cadena alfa1 y al otro,
cadena alfa2. Es sintetizado por fibroblastos, condroblastos y osteoblastos. Su función principal es la de
resistencia al estiramiento.
presenta en fibrillas estriadas de 20 a 100 nm de diámetro, agrupándose para formar fibras colágenas mayores.
Sus subunidades mayores están constituidas por cadenas alfa de dos tipos, que difieren ligeramente en su
composición de aminoácidos y en su secuencia. A uno de los cuales se designa como cadena alfa1 y al otro,
cadena alfa2. Es sintetizado por fibroblastos, condroblastos y osteoblastos. Su función principal es la de
resistencia al estiramiento.
Colágeno tipo II: Se encuentra sobre todo en el cartílago, pero también se presenta en la córnea embrionaria y
en la notocorda, en el núcleo pulposo y en el humor vítreo delojo. En el cartílago forma fibrillas finas de 10 a 20
nanómetros, pero en otros microambientes puede formar fibrillas más grandes, indistinguibles morfológicamente
del colágeno tipo I. Están constituidas por tres cadenas alfa2 de un único tipo. Es sintetizado por el
condroblasto. Su función principal es la resistencia a la presión intermitente.
en la notocorda, en el núcleo pulposo y en el humor vítreo delojo. En el cartílago forma fibrillas finas de 10 a 20
nanómetros, pero en otros microambientes puede formar fibrillas más grandes, indistinguibles morfológicamente
del colágeno tipo I. Están constituidas por tres cadenas alfa2 de un único tipo. Es sintetizado por el
condroblasto. Su función principal es la resistencia a la presión intermitente.
Colágeno tipo III: Abunda en el tejido conjuntivo laxo, en las paredes de los vasos sanguíneos, la dermis de la
piel y el estroma de varias glándulas. Parece un constituyente importante de las fibras de 50 nanómetros que
se han llamado tradicionalmente fibras reticulares. Está constituido por una clase única de cadena alfa3. Es
sintetizado por las células del músculo liso, fibroblastos, glía. Su función es la de sostén de los órganos
expandibles.
piel y el estroma de varias glándulas. Parece un constituyente importante de las fibras de 50 nanómetros que
se han llamado tradicionalmente fibras reticulares. Está constituido por una clase única de cadena alfa3. Es
sintetizado por las células del músculo liso, fibroblastos, glía. Su función es la de sostén de los órganos
expandibles.
Colágeno tipo IV: Es el colágeno que forma la lámina basal que subyace a los epitelios. Es un colágeno que
no se polimeriza en fibrillas, sino que forma un fieltro de moléculas orientadas al azar, asociadas a
proteoglicanos y con las proteínas estructurales laminina y fibronectina. Es sintetizado por las células
epiteliales y endoteliales. Su función principal es la de sostén y filtración.
no se polimeriza en fibrillas, sino que forma un fieltro de moléculas orientadas al azar, asociadas a
proteoglicanos y con las proteínas estructurales laminina y fibronectina. Es sintetizado por las células
epiteliales y endoteliales. Su función principal es la de sostén y filtración.
Colágeno tipo V: Presente en la mayoría del tejido intersticial. Se asocia con el tipo I.
Colágeno tipo VI: Presente en la mayoría del tejido intersticial. Sirve de anclaje de las células en su entorno. Se asocia con el tipo I.
Colágeno tipo VII: Se encuentra en la lámina basal.
Colágeno tipo VIII: Presente en algunas células endoteliales.
Colágeno tipo IX: Se encuentra en el cartílago articular maduro. Interactúa con el tipo II.
Colágeno tipo X: Presente en cartílago hipertrófico y mineralizado.
Colágeno tipo XI: Se encuentra en el cartílago. Interactúa con los tipos II y IX.
Colágeno tipo XII: Presente en tejidos sometidos a altas tensiones, como los tendones y ligamentos.
Interactúa con los tipos I y III.
Interactúa con los tipos I y III.
Colágeno tipo XIII: Es ampliamente encontrado como una proteína asociada a la membrana celular. Interactúa con los tipos I y III.
Colágeno tipo XIV: Aislado de placenta; también detectado en la médula ósea.
Colágeno tipo XV: Presente en tejidos derivados del mesenquíma.
Colágeno tipo XVI: Intima asociación con fibroblastos y células musculares lisas arteriales; no se asocia fibrillas colágenas tipo I.
Colágeno tipo XVII: Colágeno de Transmembrana no se halla habitualmente en la membrana plasmática de las células.
Colágeno tipo XVIII: Presentes en las membranas basales, epiteliales y vasculares.
Colágeno tipo XIX: Se localiza en fibroblastos y en el hígado.
Colágeno tipo XX: Presente en la córnea, en el cartílago esternal y en los tendones.
Colágeno tipo XXI: Hallado en encías, músculo cardíaco y esquelético y otros tejidos humanos con fibrillas de colágeno tipo I.
Suscribirse a:
Entradas (Atom)