La unión de dos o más aminoácidos (AA) mediante enlaces amida origina los péptidos. En los péptidos y en las proteínas, estos enlaces amida reciben el nombre de enlaces peptídicos y son el resultado de la reacción del grupo carboxilo de un AA con el grupo amino de otro, con eliminación de una molécula de agua (Figura de abajo).
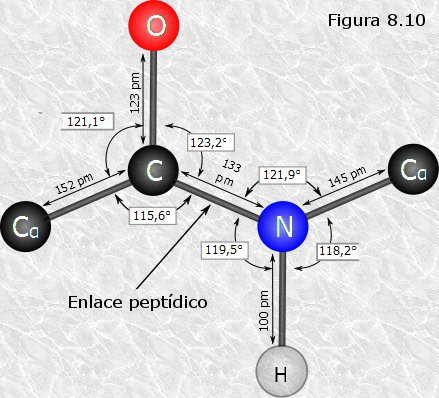
El enlace peptídico (-CO-NH-) se representa normalmente como un enlace sencillo. Sin embargo, posee una serie de características que lo aproximan más a un doble enlace.Como el nitrógeno es menos electronegativo que el oxígeno, el enlace C-O tiene un 60% de carácter de doble enlace mientras que el enlace C-N tiene un 40%. Por tanto, los enlaces C-O y N-C del enlace peptídico tienen características intermedias entre el enlace sencillo y el enlace doble. De hecho, las distancias interatómicas medidas en los enlaces C-O y C-N son intermedias entre las del enlace sencillo y el doble enlace. Esta disposición atómica está estabilizada por resonancia (Primer figura), de forma que los seis átomos implicados en la formación del enlace peptídico están contenidos en el mismo plano (Segunda figura).
|
| Normalmente, la configuración trans está favorecida. Sólo en el caso de que el segundo AA del enlace peptídico sea la prolina puede resultar favorecida la configuración cis. |
 Los péptidos sólo podrán cambiar de conformación mediante el giro en torno a los enlaces sencillos en los que intervienen los Catetraédricos (Figura de la derecha). Los péptidos sólo podrán cambiar de conformación mediante el giro en torno a los enlaces sencillos en los que intervienen los Catetraédricos (Figura de la derecha).En cada AA, el Ca puede establecer dos ángulos de torsión con los planos de los dos enlaces peptídicos contiguos: los llamados f (phi)y y (psi) (Figura de la derecha):
En la estructura de un péptido o de una proteína, cada AA presenta un valor de f y otro de y determinados. Es el tamaño físico de los átomos o grupos de átomos presentes en las cadenas laterales el que determina los posibles valores que pueden adoptar los ángulos phi (f) y psi (y).  Cuando se representan los valores de phi (f) y psi (y) de cada AA se obtiene la gráfica de Ramachandran (Figura de la izquierda), en la que se distinguen tres regiones con valores "permitidos" de los ángulos de torsión ya que no dan lugar a impedimentos estéricos en la estructura. Cuando se representan los valores de phi (f) y psi (y) de cada AA se obtiene la gráfica de Ramachandran (Figura de la izquierda), en la que se distinguen tres regiones con valores "permitidos" de los ángulos de torsión ya que no dan lugar a impedimentos estéricos en la estructura.Estas regiones corresponden a los dos tipos de elementos estructurales mayoritarios presentes en las proteínas: la estructurab y la a-hélice. Todo crédito a su respectivo dueño. Yo lo único que hago es compartir sus conocimientos. |






No hay comentarios:
Publicar un comentario